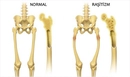
Fosfatın lewis yapısı nasıl gösterilir?
Fosfatın Lewis yapısı, bu önemli anyonun kimyasal özelliklerini ve reaktivitesini anlamada kritik bir rol oynamaktadır. Fosfor atomunun merkezi konumda yer aldığı ve çevresinde dört oksijen atomunun bulunduğu bu yapı, molekülün etkileşimlerini ve davranışlarını belirlemede yardımcı olur.
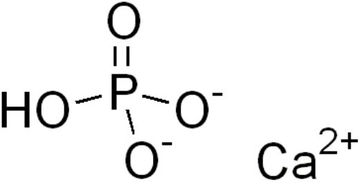
Fosfatın Lewis Yapısı Nasıldır?Fosfat, kimyasal formülü PO₄³⁻ olan bir anyondur ve birçok biyolojik ve kimyasal süreçte önemli bir rol oynamaktadır. Fosfatın Lewis yapısını anlamak, onun kimyasal özelliklerini ve reaktivitesini anlamak açısından kritik bir adımdır. Bu makalede, fosfatın Lewis yapısının nasıl gösterileceği ve bunun önemi üzerinde durulacaktır. Lewis Yapısı Nedir?Lewis yapısı, bir molekül veya iyonun atomları arasındaki bağları ve serbest elektron çiftlerini gösteren bir diyagramdır. Bu yapı, atomların nasıl birleştiğini ve molekülün şeklinin nasıl oluştuğunu anlamaya yardımcı olur. Lewis yapısı, elementlerin sembollerini ve yanlarına yerleştirilen nokta sistemini kullanarak elektron dağılımını temsil eder. Fosfat İyonunun Elektron Dizilimi Fosfat iyonunun elektron dizilimi, fosfor ve oksijen atomlarının elektron sayıları üzerinden belirlenir. Fosfor atomu, periyodik tabloda grup 15'te yer alır ve 5 valans elektronuna sahiptir. Oksijen atomu ise grup 16'da yer alır ve 6 valans elektronuna sahiptir. Fosfat iyonunun Lewis yapısını oluştururken şu adımları izleriz:
Fosfatın Lewis Yapısının Gösterimi Fosfatın Lewis yapısını gösterirken, fosfor atomu merkezi atom olarak yer alır ve çevresinde dört oksijen atomu bulunur. Her oksijen atomu, fosfor atomuna kovalent bağlarla bağlıdır. Oksijen atomları, kendi valans elektronlarıyla fosfor atomunun valans elektronları arasında paylaşım yaparak bağ oluştururlar. Lewis yapısı şu şekilde gösterilebilir:
Örnek Lewis Yapısı Fosfatın Lewis yapısının şematik gösterimi aşağıda verilmiştir: O ||O == P == O | O⁻Bu diagramda, fosfor atomu merkezde yer almakta ve dört oksijen atomu etrafında konumlanmaktadır. İki oksijen atomu, fosfor atomuna çift bağ ile bağlıdır, diğer iki oksijen atomu ise tek bağ ile bağlıdır. Bu yapı, fosfatın kimyasal özelliklerini ve reaktivitesini anlamak için kritik bir önem taşımaktadır. Fosfatın Kimyasal Özellikleri ve Önemi Fosfat, canlı organizmaların hücresel yapılarında önemli bir bileşendir. DNA ve RNA'nın yapı taşlarından biri olmasının yanı sıra, enerji taşıyıcı molekül ATP'nin de önemli bir bileşenidir. Fosfat, hücresel enerji metabolizmasında ve birçok biyokimyasal reaksiyonda kritik bir rol oynar. Fosfatın Lewis yapısı, bu molekülün reaktivitesini ve diğer bileşiklerle etkileşimini anlamamıza yardımcı olur. Sonuç Fosfatın Lewis yapısı, bu bileşiğin kimyasal özelliklerini ve reaktivitesini anlamak için kritik bir araçtır. Fosfor atomunun merkezi konumda olduğu ve dört oksijen atomunun etrafında konumlandığı bu yapı, fosfatın nasıl davrandığını ve diğer bileşenlerle nasıl etkileşime girdiğini belirlemede önemli bir rol oynamaktadır. Lewis yapısı, kimyasal bağların ve elektron dağılımının görsel bir temsilini sunarak, öğrenciler ve araştırmacılar için önemli bir öğrenme aracıdır. |